
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, распад солей, кислот и оснований в водных растворах на заряженные противоположным электричеством ионы, т. е. атомы или группы атомов, несущие на себе электрический заряд. Электрический ток проходит только через растворы таких веществ, к-рые способны давать ионы. Эти вещества называются электролитами. Ионы, идущие к катоду (к отрицательно заряженному полюсу), называются катионами, а идущие к аноду (положительному полюсу) - анионами. Хим. соединения, неспособные давать в водных растворах ионы (напр., сахар, глицерин, спирт и пр.) и не проводящие тока, называются неэлектролитами.
Распад электролитов происходит так. обр., что их молекулы диссоциируют на части, из к-рых одни заряжены положительно, а др. отрицательно. Напр.:
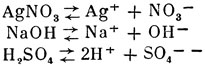
Положительные и отрицательные заряды ионов, на к-рые распадаются молекулы при растворении вещества, всегда численно равны между собой, почему и весь раствор электронейтрален. Ионы, отличаясь от электронейтральных атомов и молекул электрическими зарядами, обладают иным запасом энергии, чем соответствующие им атомы и молекулы, а следовательно, и иными свойствами. Напр., атомы натрия разлагают воду, ионы натрия не способны разлагать воду. Молекулы хлора имеют жёлто-зелёный цвет. обладают запахом и окислительными свойствами, ядовиты, а ионы хлора бесцветны, не имеют запаха, не обладают окислительными свойствами. Хлористый натрий, содержащий ионы натрия и хлора, не только не ядовит, но является необходимым питательным веществом (см. Поваренная соль).
Электролиты способны вступать в реакции двойного обмена с другими электролитами. При этих реакциях ионы реагируют независимо один от другого:
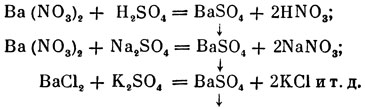
Во всех случаях получается сернокислый барий (белый осадок), независимо от того, с каким радикалом был соединён барий и с каким металлом был соединён кислотный остаток SО4. В общей ионной форме все приведённые реакции можно изобразить след. образом:
Ba+++SO4--=BaSO4.
Отношение числа диссоциированных молекул электролита к общему числу всех его молекул, заключающихся в данном объёме раствора, называют степенью электролитической диссоциации.
| a(степень э. д.)= | а(число диссоциированных молекул) | |
| б(общее числомолекул) |
Степень Э. д. зависит от след. условий: 1) природы электролита, 2) природы растворителя, 3) концентрации растворённого вещества (электролита), 4) температуры, 5) присутствия в растворе одноимённых ионов.
При взаимодействии ионов реакции идут или в сторону образования малодиссоциированных молекул, напр.
НСl+NaOH=Н2О + NaCl (в ионной форме Н++ОН-=Н2О); или труднорастворимых соединений, напр. 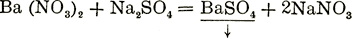 (в ионной форме
(в ионной форме 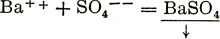 ); или веществ, удаляющихся из сферы взаимодействия в виде газов, напр. Na2CО3+H2SО4 = Na2SО4+Н2О+СО2 (в ионной форме СО3--+2Н+=(Н2СО3)→Н2О+СО2).
); или веществ, удаляющихся из сферы взаимодействия в виде газов, напр. Na2CО3+H2SО4 = Na2SО4+Н2О+СО2 (в ионной форме СО3--+2Н+=(Н2СО3)→Н2О+СО2).
Если в результате реакций между ионами не образуются ни малодиссоциированные молекулы, ни труднорастворимые вещества, ни газообразные (летучие) вещества, то между ионами устанавливается подвижное равновесие, напр. КСl+NaNO3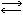 KNO3+NaCl(в ионной форме К++Cl-+Na++NO3
KNO3+NaCl(в ионной форме К++Cl-+Na++NO3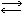 К++NO3-+Na++Cl-).
К++NO3-+Na++Cl-).
Сила кислот и оснований всецело связана с их степенью диссоциации; чем более степень диссоциации, тем сильнее соответствующая кислота или щёлочь (см. Кислоты, Соли, Щёлочи, а также Растворы).
Теория электролитической диссоциации и ионные реакции лежат в основе современной аналитической химии.
Литература - см. Растворы.
Источники:
- Сельскохозяйственная энциклопедия. Т. 5 (Т - Я)/ Ред. коллегия: П. П. Лобанов (глав ред) [и др.]. Издание третье, переработанное - М., Государственное издательство сельскохозяйственной литературы, М. 1956, с. 663
|
ПОИСК:
|
© AGROLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://agrolib.ru/ 'Библиотека по агрономии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://agrolib.ru/ 'Библиотека по агрономии'